Materi Reaksi Reduksi - Oksidasi
3:53:00 PM
Add Comment
Materi Redoks - Reaksi reduksi dan oksidasi banyak dijumpai dalam kehidupan sehari-hari. Contohnya perkaratan besi, proses pembakaran minyak tanah, metabolisme makanan dalam tubuh mahkluk hidup. Konsep bilangan oksidasi:''
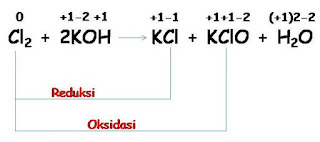 |
| reaksi reduksi oksidasi |
- Bilangan oksidasi unsur bebas, tidak beriakatan dengan unsur lain adalah nol.
- Bilangan oksidasi unsur alkali dan alkali tanah dalam senyawa +1 +2.
- Bilangan oksidasi oksigen dalam senyawa -2, kecuali dalam senyawa peroksida -1, dalam super oksida -1/2 dan dalam senyawa 〖OF〗_2= +2.
- Bilangan oksidasi hydrogen +1, kecuali dalam senyawa hidrida logam, persenyawaan hydrogen dengan logam, bilangan oksidasi hydrogen -1.
- Jumlah bilangan oksidasi senyawa netral adalah nol, senyawa bermuatan sesuai dengan muatannya.
Oksidasi
Oksidasi adalah suatu perubahan kimia yang terjadi jika:
- Suatu zat memberikan atau melepas elektronnya kepada zat lain
- Suatu zat mengalami kenaikan bilangan oksidasi
- Reaksi yang terjadi di anode suatu sel elektrokimia
Materi Lain: Ringkasan Materi Ikatan Kimia dan Struktur Molekul
Reduksi
Reduksi adalah suatu perubahan kimia yangterjadi jika:
- Suatu xat menerima atau menangkap elektron dari zat lain
- Suatu zat mengalami penurunan bilangan oksidasi
- Reaksi yang terjadi di katode suatu sel elktrokimia
- Oksidator adalah unsur yang mengalami reduksi.
- Reduktor adalah unsur yang mengalami oksidasi.
Penyetaraan reaksi redoks dapat dilakukan melalui dua cara, yaitu:
Cara bilangan oksidasi, langkah-langkahnya:
- Tentukan bilangan oksidasi masing-masing atom unsur yang terlibat dalam reaksi baik reaktan maupun produk.
- Tentukan unsur-unsur yang mengalami perubahan bilangan oksidasi.
- Samakan jumlah atom unsur yang mengalami perubahan bilangan oksidasi sebelum dan sesudah reaksi.
- Tentukan jumlah elektron yang dilepas dan diterima oleh unsur-unsur yang mengalami perubahan bilangan oksidasi.
- Samakan jumlah elektron yang dilepas dengan yang diterima melalui koefisien unsur-unsur yang mengalami perbahan bilangan oksidasi.
- Sesuaikan koefisien reaksi untuk menyetarakan unsur-unsur yang tidak mengalami perubahan bilangan oksidasi.
Cara setengah reaksi, langkah-langkahnya:
- Uraikan reaktan dan produk reaksi menjadi ion-ionnya.
- Tentukan bilangan oksidasi masing-masing atom unsur yang terlibat dalam reaksi maupun produk.
- Tentukan suasana reaksi redoks.
- Pisahkan setengah reaksi produk dan setengah reaksi oksidasi.
- Setarakan persamaan setengah reaksi reduksi dan setengah reaksi oksidasi melalui langkah berikut:
- Samakan jumlah atom unsur yang mengalami perubahan bilangan oksidasi
- Jika tidak mengandung oksigen setarakan jumlah muatan di kiri dan kanan tanda reaksi dengan menambahkan elektron
- Jika mengandung oksigen setarakan jumlah oksigen dengan menambahkan H_2 O pada pihak yang kekurangan oksigen, dan tambahkan H^+ pada pihak yang kelebihan oksigen. Atau H_2 O pada pihak yang kelebihan oksigen sesuai dengan kelebihannya, dan tambahkan 〖OH〗^- pada pihak yang kekurangan oksigen(untuk suasana basa).
Ekuivalensi redoks
Dalam redoks jumlah oksidator selalu ekuivalen dengan jumlah reduktor. Satu ekivalen reduktor adlah sejumlah oksidator yang dapat menerima satu mol elektron dalam reaksi reduksinya. Sat mol reduktor adalah sejumlah reduktor yang dapat melepaskan satu mol elektron dalam reaksi oksidasinya.
Apabila kalian sudah paham dengan materi diatas silahkan coba Bank Soal Kimia Kelas 10 SMA - Bab Konsep Reaksi Reduksi Oksidasi (Redoks).
Demikian adalah materi reduksi oksidasi dalam kimia dasar. Semoga materi diatas dapat bermanfaat untuk kalian dalam belajar kimia. Sekian dari kami dan terima kasih. Jangan lupa tinggalkan komen dan share ke temen kalian ya. Have Fun Chemistry :)





0 Response to "Materi Reaksi Reduksi - Oksidasi"
Post a Comment