Ringkasan Materi Elektrokimia SMA Kelas X
11:22:00 PM
Add Comment
Materi Elektrokimia - Pada kesempatan kali ini kami akan berbagi mengenai materi elektrokimia. Materi ini pasti kalian temui saat kalian di SMA kelas X. Kami akan membahas mengenai sel elektrokimia, daya gerak listrik DGL sel listrik, potensial electrode standart, dan lainnya. Silahkan kalian simak materinya dibawah ini :
Sel elektrokimia
Sel elektrokimia merupakan seperangkat komponen peralatan dan bahan elektrolit yang dapat menghantarkan arus listrik. Sel elektrokimia terdiri dari elektrolit dan electrode dan penghantar luar. Elektrolit dapat berupa larutan atau leburan. Electrode tercelup dalam elektrolit.
Macam-macam sel elektrokimia :
Sel volta
Sel volta atau sel galvani adalah reaksi kimia yang menghasilkan arus listrik. Pada sel galvani di anode terjadi reaksi oksidasi sehingga menghasilkan elektron. Selanjutnya elektron dialirkan ke katode melalui penghantar luar, sehingga electrode anode dikatakan sebagai kutub negatif karena sebagai sumber elektron. Sebaliknya katode diakatakan sebagai kutub positif karena menerima elektron. Terdapat dua jenis sel volta yaitu sel volta reversible dan sel volta komersial.
 |
| penerapan sel volta |
Sel Daniel
Sel Daniel tersusun oleh dua sistem setengah sel electrode. Sistem setengah sel pertama adalah logam setengah Zn yang dicelupkan ke dalam larutan seng sulfat. 〖ZnSO〗_4, larutan tembaga sulfat 〖CuSO〗_4, kedua sistem larutan dijaga sedmikian rupa sehingga tidak bercampur dengan cara member pembatas membrane berpori atau dipisahkan tetapi keduanya dihubungkan dengan jembatan garam. Kedua ujung logam yang tidak tercelup ke dalam larutan dihubungkan dengan penghantar logam.
 |
| sel daniel |
Gambar di atas merupakan bagian-bagian dari roket. Reaksi redoks akan terjadi pada pembakaran bahan bakar. Pada umumnya roket diisi dengan bahan bakar dan cairan pengoksidasi (oksidator). Bahan bakar dan oksidator bercampur dan terbakar dalam ruang pembakaran. Keberadaan zat pengoksidasi.
Mater Lain : Ringkasan Materi Ikatan Kimia dan Struktur Molekul
Daya gerak listrik DGL Listrik Sel
DGL atau Esel merupakan besarnya perbedaan potensial yang menyatakan ukuran perbedaan antara kedua electrode untuk mendorong elektron ke sirkuit lura. Daya dorong tersebut merupakan energi listrik. Satuan DGL adalah Volt.
Electrode pembanding (Reference Electrodes)
Ada dua macam electrode standart yang sering digunakan untuk pengukuran potensial electrode, yaitu:
Electrode Hidrogen Standar (Standart Hydrogen Elektrode, SHE)
Electrode hydrogen tersusun dari gas hidrogen, lempeng dan kawat platina, serta larutan yang mengandung ion H^+. Gas hidrogen dialirkan ke dalam tabung yang di dalamnya terdapat lempeng platina yang telah dilapisi dengan platina hitam. Lempeng platina berpori dihubungkan dengan sirkuit luar melalui kawat platina. Ujung tabung yang terdapat lempeng platina berpori dicelupkan ke dalam larutan yang mengandung ion H^+. Gas hidrogen diabsorb oleh lempeng platina, sehingga pada permukaan lempeng terjadi kontak antar muka antara H_2 dengan ion H^+, sehingga terjadi sistem kesetimbangan.
Electrode kalomel standart (Calomel Reference Elektrode)
Electrode kalomel standart merupakan sistem electrode yang tersusun oleh raksa yang bersentuhan dengan larutan KCl yang telah dijenuhkan dengan kalomel (〖Hg〗_2 〖Cl〗_2). Gambar electrode kalomel
Potensial electrode standart
Potensial electrode standart menyatakan besarnya potensial suatu sistem electrode jika electrode tersebut dipasangkan dengan electrode hidrogen standart. Dalam hal ini elketrode hidrogen dianggap mengalami oksidasi atau bertindak sebagai anode, sedang electrode pasangannya atau electrode yang diukur potensialnya dipasang sebagai katode.
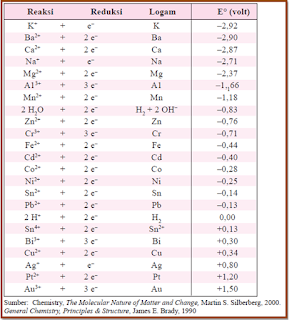 |
| tabel potensial electrode standart |
Pengaruh perubahan volume atau tekanan sistem
Perubahan volume kesetimbangan berarti merubah konsentrasi zat-zat yang ada dalam sistem kesetimbangan. Jika volume sistem diperbesar berarti konsentrasi zat-zat yang ada dalam sistem kesetimbangan mengalami penurunan. Apabila volume sistem diperbesar maka tekanan sistem mengalami penurunan.
Materi Lain : Perubahan Fisika dan Kimia Zat
Pengaruh perubahan temperatur
Pergeseran kesetimbangan karena perubahan temperatur berkaitan erat dengan perubahan energi bebas reaksi dan perubahan entalpi reaksi. Bila suatu sistem kesetimbangan kea rah pembentukan produk merupakan reaksi eksoterm (ΔH<0), maka reaksi kea rah pembentukan reaktan merupakan reaksi endoterm (ΔH>0) dan sebaliknya.
Notasi sel
Garis vertikal tunggal, digunakan sebagai symbol antar muka antara terminal padat dengan larutan.
Garis vertikal ganda, menyimbolkan jembatan garam atau partisi berpori.
Tanda koma (,) menyimbolkan batas reaksi oksidasi-reduksi antar ion-ion atau ion-ion unsur dari unsur sejenis.
Reaksi oksidasi yang terjadi di anode diletakkan pada bagian sebelah kiri, sedang reaksi reduksi yang terjadi di katode sebelah kanan.
Termodinamika sel elektrokimia
Besaran termodinamika energi listrik dalam sel elektrokimia merupakan perubahan energi bebas gibbs (ΔG), yang hanya dapat diukur bila sel bersifat reversible. Realita yang terjadi bahwa sel elektrokimia tidak bersifat reversible. Karena adanya sejumlah besar arus listrik yang bergerak melalui rangkaian sel. Dengan demikian kondisi sistem sel memberikan pengaruh terhadap besarnya energi listrik yang dihasilkan oleh suatu sel. Besarnya potensial sel secara umum diformulasikan sebagai berikut :
Demikian adalah pembahasan kimia tentang materi elekrokimia kelas x. Semoga materi diatas dapat membantu teman-teman dalam mempelajari materi kimia ini. Jangan lupa tinggalkan komentar kalian mengenai materi ini. Sekian dari kami dan terima kasih. Have fun with chemistry :)






0 Response to "Ringkasan Materi Elektrokimia SMA Kelas X"
Post a Comment