Ringkasan Materi Wujud Zat Kelas 10 SMA
12:33:00 PM
Add Comment
Ringkasan Wujud Zat - Pada kesempatan kali ini kami akan membahas seputar wujud gas yang ada di dalam sekitar kita. Terdapat 3 wujud zat di dalam kehidupan. Wujud zat dalam kehidupan sehari-hari tersebut adalah gas, cair, dan padat. Berikut adalah materi tentang zat gas, cair, dan padat :
Wujud zat:
1.Wujud gas
Wujud gas, partikel penyusun gas dapat berupa molekul, atom atau ion. Pada wujud gas, jarak antar partikel saling berjauhan, jauh lebih panjang dibandingkan ukuran jari-jari partikel. Partikel bergerak bebas mengikuti garis lurus. Tumbukan antar partikel dan antara partikel dengan dinding wadah lenting sempurna. Partikel gas memiliki energi translasi yang sangat besar, energi vibrasi yang sangat kecil, sehingga gas mudah mengalir dikategorikan fluida.
2.Wujud cair
Partikel penyusun zat cair dapat berupa molekul, atom atau ion. Merupakan keadaan diantara wujud gas dan padat. Jarak antar partikel relatif berdekatan. Partikel memiliki energi translasi yang cukup besar dan energi vibrasi. Energi translasi memungkinkan partikel bergerak bebas, sehingga wujud cair dapat dikategorikan fluida.
3.Wujud padat
Partikel penyusun zat padat berupa molekul, ion atau atom yang saling berhimpitan, sehingga partikel sukar bergerak, tetap pada tempatnya. Partikel hanya memiliki energi vibrasi. Pada umumnya zat padat berbentuk Kristal dan memiliki bentuk geometri tertentu.
 |
| materi wujud zat kimia kelas x |
Peralihan dan kesetimbangan fasa
Faktor yang mempengaruhi keadaan suatu zat adalah suhu dan tekanan. Kedua faktor tersebut menentukan kesetimbangan fasa diantara wujud gas, padat dan cair dari zat atau materi yang sama.
Kesetimbangan fasa suatu sistem harus memenuhi:
- Sistem meiliki lebih dari satu fasa meskipun materinya sama
- Terjadi perubahan wujud yang reversible dari satu fasa ke fasa lainnya
- Seluruh bagian sistem memiliki suhu dan tekanan yang sama
Wujud gas
Model gas ideal dikembangkan melalui teori kinetik tentang gas. Melalui tori ini dapat dijelaskan hukum-hukum tentang gas ideal yang berkaitan dengan kecepatan gerak partikel gas, energi partikel gas sebagai fungsi temperatur. Tekanan (P) adalah gaya persatuan luas, gaya menyatakan perubahan momentum per satuan waktu. Satuan tekanan SI adalah pascal, sedangkan yang umm digunakan adalah atmosfir (atm).
Hukum-hukum gas
1. Hukum boyle (volume tekanan)
Pada suhu konstan, volume sejumlah gas berbanding terbalik dengan tekanannya, secara matematik dirumuskan :
V~1/P sehingga PV=C
Dimana V adalah volume gas, P adalah tekanan gas dan C adalah konstanta.
Gambar hubungan antara PV
Penerapan Hukum Boyle terdapat pada prinsip kerja pompa. Pompa adalah alat yang digunakan untuk memindahkan gas atau zat cair. Berdasarkan prinsip kerja ini, pompa dikelompokkan menjadi dua jenis, yaitu pompa hisap dan pompa tekan.
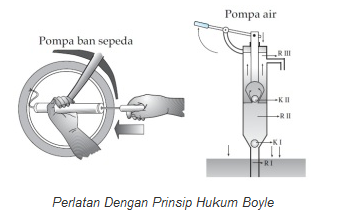 |
| gambar hukum boyle |
2. Hukum Charles (hukum volume temperatur)
Pada tekanan konstan, volume sejumlah gas berbanding lurus dengan suhu/temperatur absolutenya, secara matematis diformulasikan:
V~T sehingga V/T=C
Dimana V adalah volume gas, T adalah suhu / temperatur, dan C adalah konstanta.
Gambar grafik hubungan antara VT
3. Hukum Dalton
Dalton mengemukakan beberapa teori tentang campuran gas. Teori-teori tersebut diuraikan sebagai berikut:
- Pada temperatur dan tekann tertentu, volume setiap bagian campuran gas dinamakan volume parsial.
Vtotal=V1+V2+V3+……..+Vn
- Pada temperatur dan volume tertentu, dalam campuran gas, tekanan yang diberikan oleh masing-masing gas disebut tekanan parsial.
Ptotal= P1+P2+P3+………+Pn
- Besarnya tekanan parsial gas sama dengan fraksi mol x gas dalam campuran dikalikan dengan tekanan total campuran gas, Ptotal. Secara matematik
Pt=xt . Ptotal4. Hukum Gay Lussac(penyatuan volume) dalam reaksi kimia gas
Dalam reaksi kimia antara gas-gas, volume gas-gas yang bereaksi dan volume gas-gas hasil reaksi jika diukur pada kondisi tekanan yang sama, berbanding sebagai bilangan yang mudah dan bulat, sesuai denganperbandingan koefisien dalam persamaan reaksi. Contohnya adalah botol yan tertutup atau kaleng aerosol yang dilempar ke api maka akan meledak karena naiknya tekanan gas di dalamnya.
Materi Lain : Pembahasan Partikel Materi
5. Hukum Avogadro
Pada temperatur dan tekanan yang konstan volume gas berbanding langsung dengan jumlah mol gas. Semua gas pada temperatur dan tekanan yang sama, jika volumenya sama maka mengandung jumlah molekul yang sama. Pada keadaan temperatur dan tekanan standart yaitu 0°C, 1 atmosfir, yang biasa dikenal dkeadaan (STP), setiap 1 mol gas sembarang gas volumenya 22,4 Liter. Contoh dalam kehidupan sehari-hari reaksi antara gas N2 dan gas O2 menghasilkan gas NO2.
1 volume N2 + 2 volume O2 →2 volume NO2Jika reaksi diukur pada suhu dan tekanan yang sama, jumlah molekul O2 yang bereaksi dua kali jumlah molekul N2 (volumenya 2×) dan jumlah molekul NO2 yang dihasilkan dua kali jumlah molekul N2 atau sama dengan jumlah molekul O2. Oleh karena hipotesis Avogadro dapat diterima kebenarannya dan dapat dibuktikan (kapan pun, di mana pun, oleh siapa pun) maka hipotesis tersebut telah dikukuhkan sebagai Hukum Avogadro.
1 molekul N2 + 2 molekul O2 →2 molekul NO2
n molekul N2 + 2n molekul O2 →2n molekul NO2
6. Hukum Graham(Difusi dan Efusi Gas)
Pada temperatur dan tekanan yang sama, kecepatan difusi gas-gas berbanding terbalik dengan akar massa molekulnya atau kerapatannya. Secara matematik diformulasikan:
 |
| rumus hukum graham |
Dimana MA dan MB massal molekul gas rAdan rB laju reaksi gas sedang dA dan dB kerapatan gas. Laju efusi gas pada kondisi tekanan dan temperatur yang sama berbanding terbalik dengan kerapatannya. Secara matematik diformulasikan:
Dimana v adalah laju efusi gas dan ρ adalah kerapatan gas. Semakin besar massa molekul relatif semakin kecil laju difusi datau laju efusi gas tersebut.
7. Gas ideal dangas nyata
Gas ideal didefinisikan sebagai gas-gas, dimana antara partikel-partikel gas tidak terjadi tolak menolak atau tarik menarik, gerakan partikel gas bebas dan lurus, tumbukan antar partikel gas maupun partikel gas dengan dinding wadahnya lenting sempurna.
Persamaan gas ideal
 |
| rumus hukum gas ideal |
Dimana P tekanan, V volume sistem, n jumlah mol gas, T temperatur gas dan R suatu tetapan Roult yang besarnya 0,082 L.atm.〖mol〗^(-1) K^(-1)
Wujud padat
Zat padat secara umum dapat dikelompokkan menjadi dua yaitu:
Padatan berbentuk Kristal
Padatan Kristal memiliki titik lebur yang tegas, dapat mendifraksikan sinar X yang dikenakan padanya. Kristal pada umumnya memiliki struktur geometric tertentu yang dipelajari melalui bidang kristalografi optic dan kristalografi sinar X.
Padatan berbentuk amorf
Padatan amorf titik leburnya tidak tegas. Pada umumnya padatan amorf hanya sedikit di alam.
Volume satuan sel (efisiensi sel)
Setiap satuan sel terdiri oleh sejumlah partikel, namun tidak semua ruang dalam sel terisi oleh volume partikel tetapi masih ada ruang kosong di sekitar partikel karena partikel dimodelkan sebagai bola. Secara matematis:
Wujud cair
Pada wujud cair, partikel saling berdekatan tetapi tidak saling bersinggungan, namun masih terdapat gaya tarik menarik antar partikel, sehingga cairann dapat dituangkan. Struktur penyusun cairan berada diantara struktur gas dan padat.
Tegangan permukaan
Timbulnya tegangan permukaan zat cair adalah adanya resultan gaya tarik antar molekul di dalam cairan adalah nol. Gaya tarik antar partikel di permukaan cairan menimblkan gaya resultan yang mengarah ke dalam cairan, sehingga pada bagian permukaan zat cair mengalami tegang antar partikel.
Materi Lain : Ringkasan Materi Sistem Periodik Unsur
Tekanan uap
Partikel-partikel zat cair yang berada di permukaan zat cair cenderung meninggalkan zat cair jika memiliki energi kinetic yang cukup untuk melawan gaya tarik partikel yang ada di bawahnya dan disekelilingnya. Peristiwa tersebut dinamakan proses penguapan.
Viskositas
Viskositas merupakan suatu parameter indeks hambatan alir zat cair murni maupun larutan. Viskositas zat cair dapat diukur melalui hukm Poiseulle, yaitu pengukuran laju alir zat cair melalui tabung berbentuk silinder. Jumlah volume zat cair yang melalui pipa silinder tiap satuan waktu diformulasikan:
 |
| rumus viskositas |
Dimana µ viskositas zat cair, V volume total zat cair yang mengalir, t waktu yang diperlukan untuk mengalirkan zat cair, P tekanan zat cair saat mengalir, dan L panjang pipa silinder.
Demikian adalah ringkasan materi wujud zat kimia kelas x. Semoga artikel diatas dapat bemanfaat dan menambah refrensi kalian dalam belajar kimia khususnya tentang wujud zat. Sekian dari chemistry education, jangan lupa tinggalkan komentar kalian mengenai materi diatas. Terima kasih have fun with chemistry.







0 Response to "Ringkasan Materi Wujud Zat Kelas 10 SMA"
Post a Comment