Kelarutan Dan Hasil Kali Kelarutan (Ksp)
11:39:00 PM
Add Comment
Kelarutan
Pernahkah kalian melarutkan gula ke dalam segelas air??.Jika kalian masukkan 1 sendok gula kedalam satu gelas air dan diaduk maka gula itu akan larut. Tidak dapat kita bedakan mana zat terlarut (gula) dan pelarutnya (air). Jika kita masukkan lagi sesendok demi sesendok gula ke dalam segelas air tersebut maka akan ada suatu saat air dalam gelas tersebut tidak dapat melarutkan gula iti lagi. Artinya air yang segelas itu hanya mampu melarutkan sejumlah gula (zat terlarut) yang kita sebut dengan Kelarutan. Kelarutan adalah jumlah maksimum zat yang dapat larut dalam sejumlah pelarut. Kelarutan dilambangkan dengan s.
Secara matematika dapat kita tulis :
Keterangan
s = kelarutan
n = jumlah mol zat
V = Volume Larutan
Tetapan hasil kali kearutan (Ksp)
Ingat bahwa konsep kelarutan hanya berlaku pad garam garam yang sukar larut.jika suatu garam sukar larut dilarutkan ke dalam air, misalkan AgCl, maka garam tersebut akan mengion memebentuk kesetimbangan :
AgCl(s) ↔ Ag+ (aq) + Cl-(aq)
Tetapan kesetmbangan untuk reaksi ionisasi diatas adalah :
Kc = [Ag+] [Cl-]
Karena terjadi pada garam yang sukar larut maka tetapan ini disebut tetapan hasilkali kelarutan atau Ksp.
Sehingga persamaan diatas dapat ditulis:
Ksp = [Ag+] [Cl-]
Secara umum jika suatu garam sukar larut AxBy dimasukkan ke dalam air maka akan mengion membentuk kesetimbangan :
AxBy(s) ↔ xA+(aq) + yB-(aq)
Contoh : Tuliskan persamaan tetapan hasil kali kelarutan senyawa berikut :
A.PbSO4
B.Ag3PO4
Jawab :
A. PbSO4
PbSO4 ↔ Pb+2(aq) + SO4-2(aq)
Ksp = [Pb+2][ SO4-2]
B. Ag3PO4
Ag3PO4 ↔ 3Ag+ + PO43-
Hubungan Kelarutan (s) dengan Hasil Kali Kelarutan (Ksp)
Jika Garam Ag2SO4 dilarutkan ke dalam air maka garam tersebut akan memebentuk kesetimbangan ionisasi sebagai berikut:
Jika kelarutan Ag2SO4 = s, maka konsentrasi ion Ag+ dan SO42- dalam larutan adalah:
Jadi secara umum hubungan Ksp dengan S dapat ditulis :
Tuliskanlah hubungan s dengan Ksp dari senyawa :
A. CaSO4
B. Ni3(AsO4)2
Jawab :
A.CaSO4
CaSO4 ↔ Ca+2 + SO42-
s s s
B. Ni3(AsO4)2
Pernahkah kalian melarutkan gula ke dalam segelas air??.Jika kalian masukkan 1 sendok gula kedalam satu gelas air dan diaduk maka gula itu akan larut. Tidak dapat kita bedakan mana zat terlarut (gula) dan pelarutnya (air). Jika kita masukkan lagi sesendok demi sesendok gula ke dalam segelas air tersebut maka akan ada suatu saat air dalam gelas tersebut tidak dapat melarutkan gula iti lagi. Artinya air yang segelas itu hanya mampu melarutkan sejumlah gula (zat terlarut) yang kita sebut dengan Kelarutan. Kelarutan adalah jumlah maksimum zat yang dapat larut dalam sejumlah pelarut. Kelarutan dilambangkan dengan s.
Secara matematika dapat kita tulis :
Keterangan
s = kelarutan
n = jumlah mol zat
V = Volume Larutan
Tetapan hasil kali kearutan (Ksp)
Ingat bahwa konsep kelarutan hanya berlaku pad garam garam yang sukar larut.jika suatu garam sukar larut dilarutkan ke dalam air, misalkan AgCl, maka garam tersebut akan mengion memebentuk kesetimbangan :
AgCl(s) ↔ Ag+ (aq) + Cl-(aq)
Tetapan kesetmbangan untuk reaksi ionisasi diatas adalah :
Kc = [Ag+] [Cl-]
Karena terjadi pada garam yang sukar larut maka tetapan ini disebut tetapan hasilkali kelarutan atau Ksp.
Sehingga persamaan diatas dapat ditulis:
Ksp = [Ag+] [Cl-]
Secara umum jika suatu garam sukar larut AxBy dimasukkan ke dalam air maka akan mengion membentuk kesetimbangan :
AxBy(s) ↔ xA+(aq) + yB-(aq)
Contoh : Tuliskan persamaan tetapan hasil kali kelarutan senyawa berikut :
A.PbSO4
B.Ag3PO4
Jawab :
A. PbSO4
PbSO4 ↔ Pb+2(aq) + SO4-2(aq)
Ksp = [Pb+2][ SO4-2]
B. Ag3PO4
Ag3PO4 ↔ 3Ag+ + PO43-
Jika Garam Ag2SO4 dilarutkan ke dalam air maka garam tersebut akan memebentuk kesetimbangan ionisasi sebagai berikut:
Jika kelarutan Ag2SO4 = s, maka konsentrasi ion Ag+ dan SO42- dalam larutan adalah:
Jadi secara umum hubungan Ksp dengan S dapat ditulis :
Tuliskanlah hubungan s dengan Ksp dari senyawa :
A. CaSO4
B. Ni3(AsO4)2
Jawab :
A.CaSO4
CaSO4 ↔ Ca+2 + SO42-
s s s
B. Ni3(AsO4)2


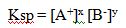











0 Response to "Kelarutan Dan Hasil Kali Kelarutan (Ksp)"
Post a Comment