Materi dan Contoh Soal Hubungan Mol dengan Massa
8:00:00 AM
1 Comment
Hubungan Mol dengan massa
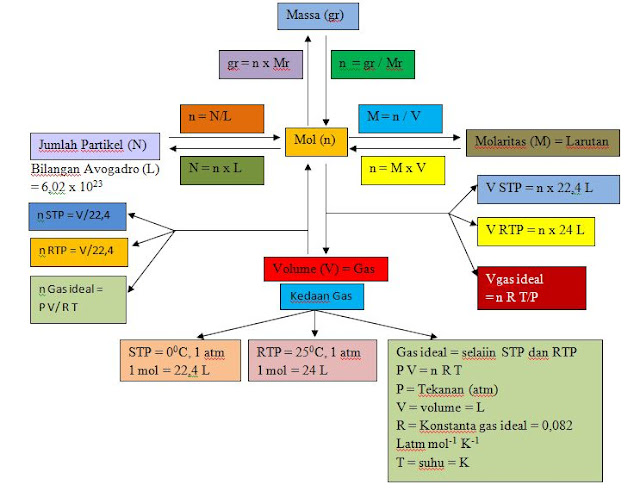
Massa 1 mol zat sering disebut dengan massa molar yaitu massa 12 gram atom C-12 sehingga massa 1 mol sama denagan Ar unsur atau Mr senyawa. Massa molar satuannya adalah gram mol-1.
Contoh :
1 mol atom C dengan Ar 12 memiliki massa 12 gram
1 mol molekul H2O dengan Mr 18 memiliki massa 18 gram
Berdasarkan contoh diatas dapat kita simpulkan bahwa hubungan massa dengan mol adalah:
Keterangan :
m = massa (gram)
n = jumlah mol (mol)
Ar = Massa atom realtif (gram mol-1)
Mr = Massa molekul relative ( gram mol-1)
Contoh :
Soal 1
Hitunglah massa dari 3 mol atom hidrogen dan 3 mol meolekul / gas hidrogen? (Ar H = 1)
Pembahasan :
Massa 3 mol atom hidrogen = n x Ar = 3 x 1 = 3 gram
Massa 3 mol molekul hidrogen = n x Mr = 3 x 2 = 6 gram
Soal 2
Jumlah mol dari 29 gram magnesium hidroksida Mg(OH)2 adalah . . . (Ar Mg = 24, O = 16 dan H = 1)
A. 0,2
B. 0,5
C. 2
D. 2,5
E. 5
Pembahasan :
Mr Mg(OH)2 = Ar Mg + 2 x Ar O + 2 x Ar H
= 24 + 2 x 16 + 2 x 1
= 24 + 32 + 2 = 58
n = gr / Mr = 29/58 = 0,5 mol
Jawaban : B
Soal 3
Dalam 2 gram senyawa berikut ini yang mempunyai jumlah mol tersebsar adalah . . . . .(Ar H = 1 , C = 12, N =14, Na = 23, O = 16)
A. H2
B. CH4
C. N2
D. NaOH
E. CO(NH2)2
Pembahasan :
Marilah kita cek satu persatu harga mol dari masing masing senyawa diatas.
Mol H2 = gr/ Mr = 2 / 2 = 1 mol
Mol CH4 = gr / Mr = 2 / 16 = 0,125
Mol N2 = gr / Mr = 2 / 28 = 0,07 mol
Mol NaOH = gr/Mr = 2 / 40 = 0,05 mol
Mol CO(NH2)2 = gr/Mr = 2 / 60 = 0,033 mol
Jadi mol terbesar pada massa 2 gram zat adalah mol H2.
Triks cepatnya : jika massanya sama , maka mol >>> ketika Mr <<<. Mol berbanding terbalik dengan Mr senyawa.
Jawaban : A
Soal 3
Diantara pasangan zat dibawah ini yang memiliki jumlah mol sama adalah . . . .(Ar H = 1, N = 14, C = 12, O = 16, K = 39)
A.2 gram gas H2 dan 7 gram gas N2
B.3 gram gas O2 dan 5 gram gas CO
C.6 gram gas H2O dan 10 gram gas CH2O
D.7 gram NaOH dan 14 gram KOH
E.10 gram CO dan 5 gram CO2
Pembahasan :
2 gram gas H2 dan 7 gram gas N2
Mol H2 = gr/Mr = 2 /2 = 1 mol
Mol N2 = gr/Mr = 7 /28 = 0,24 mol
Mol zatnya berbeda
3 gram gas O2 dan 5 gram gas CO
Mol O2 = gr/Mr = 3/32 = 0,093 mol
Mol CO = gr/Mr = 5 /28 = 0,18 mol
Mol zatnya berbeda
6 gram gas H2O dan 10 gram gas CH2O
Mol H2O = gr/Mr = 6/18 = 0,33 mol
Mol CH2O = gr/Mr = 10/30 = 0,33 mol
Mol zatnya sama
Jawaban : C
Massa 1 mol zat sering disebut dengan massa molar yaitu massa 12 gram atom C-12 sehingga massa 1 mol sama denagan Ar unsur atau Mr senyawa. Massa molar satuannya adalah gram mol-1.
Contoh :
1 mol atom C dengan Ar 12 memiliki massa 12 gram
1 mol molekul H2O dengan Mr 18 memiliki massa 18 gram
Berdasarkan contoh diatas dapat kita simpulkan bahwa hubungan massa dengan mol adalah:
Keterangan :
m = massa (gram)
n = jumlah mol (mol)
Ar = Massa atom realtif (gram mol-1)
Mr = Massa molekul relative ( gram mol-1)
Contoh :
Soal 1
Hitunglah massa dari 3 mol atom hidrogen dan 3 mol meolekul / gas hidrogen? (Ar H = 1)
Pembahasan :
Massa 3 mol atom hidrogen = n x Ar = 3 x 1 = 3 gram
Massa 3 mol molekul hidrogen = n x Mr = 3 x 2 = 6 gram
Soal 2
Jumlah mol dari 29 gram magnesium hidroksida Mg(OH)2 adalah . . . (Ar Mg = 24, O = 16 dan H = 1)
A. 0,2
B. 0,5
C. 2
D. 2,5
E. 5
Pembahasan :
Mr Mg(OH)2 = Ar Mg + 2 x Ar O + 2 x Ar H
= 24 + 2 x 16 + 2 x 1
= 24 + 32 + 2 = 58
n = gr / Mr = 29/58 = 0,5 mol
Jawaban : B
Soal 3
Dalam 2 gram senyawa berikut ini yang mempunyai jumlah mol tersebsar adalah . . . . .(Ar H = 1 , C = 12, N =14, Na = 23, O = 16)
A. H2
B. CH4
C. N2
D. NaOH
E. CO(NH2)2
Pembahasan :
Marilah kita cek satu persatu harga mol dari masing masing senyawa diatas.
Mol H2 = gr/ Mr = 2 / 2 = 1 mol
Mol CH4 = gr / Mr = 2 / 16 = 0,125
Mol N2 = gr / Mr = 2 / 28 = 0,07 mol
Mol NaOH = gr/Mr = 2 / 40 = 0,05 mol
Mol CO(NH2)2 = gr/Mr = 2 / 60 = 0,033 mol
Jadi mol terbesar pada massa 2 gram zat adalah mol H2.
Triks cepatnya : jika massanya sama , maka mol >>> ketika Mr <<<. Mol berbanding terbalik dengan Mr senyawa.
Jawaban : A
Soal 3
Diantara pasangan zat dibawah ini yang memiliki jumlah mol sama adalah . . . .(Ar H = 1, N = 14, C = 12, O = 16, K = 39)
A.2 gram gas H2 dan 7 gram gas N2
B.3 gram gas O2 dan 5 gram gas CO
C.6 gram gas H2O dan 10 gram gas CH2O
D.7 gram NaOH dan 14 gram KOH
E.10 gram CO dan 5 gram CO2
Pembahasan :
2 gram gas H2 dan 7 gram gas N2
Mol H2 = gr/Mr = 2 /2 = 1 mol
Mol N2 = gr/Mr = 7 /28 = 0,24 mol
Mol zatnya berbeda
3 gram gas O2 dan 5 gram gas CO
Mol O2 = gr/Mr = 3/32 = 0,093 mol
Mol CO = gr/Mr = 5 /28 = 0,18 mol
Mol zatnya berbeda
6 gram gas H2O dan 10 gram gas CH2O
Mol H2O = gr/Mr = 6/18 = 0,33 mol
Mol CH2O = gr/Mr = 10/30 = 0,33 mol
Mol zatnya sama
Jawaban : C






Thanks..!
ReplyDelete