Menghitung pH dan pOH Berbagai Campuran Asam - Basa
4:30:00 PM
Add Comment
Campuran Asam Kuat + Basa Kuat
HCl + NaOH → NaCl + H2O
Jika Asam Bersisa
[H+] = M asam x a
atau
[H+] = [asam] x a
a = Valensi Asam(jumlah H+ yang dilepaskan)
Jika Basa Bersisa
Maka larutan bersifat basa kuat dan pH larutan > 7. pH larutan ditentukan oleh jumlah ion OH- yang bersisa dari basa kuatnya. Untuk menghitung dapat [OH-] digunakan rumus :
[OH-] = M basa x b
atau
[OH-] = [basa] x b
b = Valensi basa9jumlah ion OH- yang dilepaskan)
Campuran Asam Kuat + Basa lemah
Jika Habis bereaksi
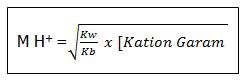
Jika Bersisa Asam
Maka larutan bersifat asam kuat karena adanya ion H+ yang bersisa dari asam kuatnya. pH larutan < 7 dan untuk menghitung [H+] digunakan rumus :
[H+] = M asam x a
atau
[H+] = [asam] x a
a = Valensi Asam(jumlah yang dilepaskan)
Jika Basa Bersisa
Maka larutan yang terbentuk bersifat penyangga basa dengan pH > 7. Untuk menghitung [] dalam larutan dapat digunakan rumus :
Campuran Asam Lemah + Basa Kuat
HCN + NaOH → NaCN + H2O
Jika Habis bereaksi
Jika Basa Bersisa
atau
[OH-] = [basa] x b
b = Valensi basa9jumlah ion OH- yang dilepaskan)
Campuran Asam Lemah + Basa Lemah
NH4OH + HCN → NH4CN + H2O
jika Ka > Kb = Larutan bersifat asam
jika Ka = Kb = Larutan bersifat netral
Jika Ka < Kb = Larutan Bersifat Basa
Berlatih soal asam basa 1
Berlatih soal asam basa 2
Berlatih soal asam basa 3 - Bank soal - Ulangan harian - Soal Latihan
HCl + NaOH → NaCl + H2O
JIka Habis Bereaksi
Maka yang dihasilkan adalah garam (NaCl) yang tidak mengalami hidrolisis sehingga larutan bersifat netral dan pH larutan adalah 7.
Jika Asam Bersisa
Maka pH larutan ditentukan oleh mol asam yang berisa. Sifat larutan adalah asam denga pH < 7.
Untuk menhitung konsentrasi digunakan rumus :[H+] = M asam x a
atau
[H+] = [asam] x a
a = Valensi Asam(jumlah H+ yang dilepaskan)
Jika Basa Bersisa
Maka larutan bersifat basa kuat dan pH larutan > 7. pH larutan ditentukan oleh jumlah ion OH- yang bersisa dari basa kuatnya. Untuk menghitung dapat [OH-] digunakan rumus :
[OH-] = M basa x b
atau
[OH-] = [basa] x b
b = Valensi basa9jumlah ion OH- yang dilepaskan)
Campuran Asam Kuat + Basa lemah
HCl + NH3 → NH4Cl
Jika Habis bereaksi
maka akan dihasilkan garam yang teridrolisis sebagian yaitu kation NH4+ dari basa lemahnya sehingga dihasikan larutan yang bersifat asam dengn pH < 7 karena pada reaksi hidrolisisnya menghasilkan ion H+
.Untuk menghitung [H+] dalam larutan digunakan rumus: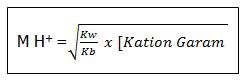
Jika Bersisa Asam
Maka larutan bersifat asam kuat karena adanya ion H+ yang bersisa dari asam kuatnya. pH larutan < 7 dan untuk menghitung [H+] digunakan rumus :
[H+] = M asam x a
atau
[H+] = [asam] x a
a = Valensi Asam(jumlah yang dilepaskan)
Jika Basa Bersisa
Maka larutan yang terbentuk bersifat penyangga basa dengan pH > 7. Untuk menghitung [] dalam larutan dapat digunakan rumus :
Campuran Asam Lemah + Basa Kuat
HCN + NaOH → NaCN + H2O
Jika Habis bereaksi
Maka dihasilkan garam yang mengalami hidrolisis parsial yaitu anion dari asam lemahnya sehingga dihasilkan ion OH- dan pH larutan > 7. Untuk menghitunh [OH-] dalam larutan dapat digunakan rumus:
Jika Asam Bersisa
Maka dihasilkan larutan penyangga asam deng pH larutan < 7. Untuk menghitung [H+] dalam larutan dapat digunakan rumus :
Jika Basa Bersisa
Maka larutan yang dihasilkan bersifat basa kuat dan [OH-] dapat dihitung menggunkan rumus:
[OH-] = M basa x batau
[OH-] = [basa] x b
b = Valensi basa9jumlah ion OH- yang dilepaskan)
Campuran Asam Lemah + Basa Lemah
NH4OH + HCN → NH4CN + H2O
Jika habis bereaksi
Maka
akan dihasilkan garam yang mengalami hidrolisis total, pH larutan
tergantung pada kekuatan relatif tetapan ionisasi asam dan basanya.
Untuk mencari [H+] dapat digunakan rumus :
jika Ka = Kb = Larutan bersifat netral
Jika Ka < Kb = Larutan Bersifat Basa
Berlatih soal asam basa 1
Berlatih soal asam basa 2
Berlatih soal asam basa 3 - Bank soal - Ulangan harian - Soal Latihan




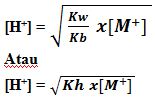





0 Response to "Menghitung pH dan pOH Berbagai Campuran Asam - Basa"
Post a Comment